#本文仅代表作者观点,不代表IPRdaily立场,未经作者许可,禁止转载#
“中国已经引入了药品专利链接制度和专利期限补偿机制,因此证实了相关期限补偿权机制是中国立法可以接受的制度。”
来源:IPRdaily中文网(iprdaily.cn)
作者:Antonia Schmidt, Toni-Junell Herbert, Eduardo Hallak, Achim Krebs, Ian Goh, Chris Shaowei, Filip De Corte
通讯作者:Dr. Sc. Filip De Corte, Head IP Syngenta Crop Protection
Part.1
引言
现代农业发展亟需创新支撑,而创新活动需要充分的知识产权保护。迄今为止,全球主要研发企业集中于美国、欧洲及日本地区。经过行业整合,该领域现已形成六大巨头:总部位于德国的拜耳(Bayer)和巴斯夫(BASF)、总部设于美国的科迪华(CORTEVA)和富美实(FMC)、总部设于日本的住友(Sumitomo),以及总部位于瑞士但由中国中化集团全资拥有的先正达(Syngenta)。
中国“十四五”规划纲要确立了宏伟的发展目标,旨在推动中国从制造大国向创新研发强国转型。该规划重点关注创新、农业和绿色生产领域,强调通过开发新型作物品种和先进防控技术,促进农业生产的可持续性和高效性。现代植物保护产品(PPP)是实现农业可持续发展的重要要素,成为这一战略规划的重点关注领域。
2025年4月30日,全球专利律师、研究人员和法律专家齐聚新加坡参加先正达举办的专利期限延长(PTE)研讨会,会议核心议题聚焦于:中国当前加入全球植物保护产品CTR体系的历史性机遇。相比日本创新型企业享有的友好CTR制度保障,以及欧洲企业通过补充保护证书获得的权益,中国农业创新者仍面临着专利保护期限不足的严峻挑战。
在农业创新这个高风险的领域,时间直接关乎经济效益。专利保护期限越短,意味着企业收回研发投资的机会越有限,这会降低跨国企业在中国设立或扩建研发设施的动力。
不过,中国经济转型为健全知识产权保护制度创造了良好机遇,有利于充分保护和激励包括植物保护方案研发者在内的各类创新主体。在中国深入实施创新驱动发展战略的进程中,完善各领域创新活动的知识产权制度,与国家长远发展规划高度契合。尤其是面对全球气候变化不断加剧、粮食安全挑战日趋严峻的形势,农业发展亟需实现突破性进展。
本次研讨会旨在系统梳理全球CTR制度实践经验,为中国建立植物保护产品市场保护制度提供可行性参考。[2]
1.1 植物保护产品与药品研发比较:时间表与成本分析
药品与农用化学品的生命周期具有显著相似性。特别值得注意的是,创新植物保护产品的研发流程与药品开发过程呈现出高度一致性。总体而言,将植物保护产品推向市场所需的研发投入与药品开发投入相当。
对于植物保护产品和药品二者而言,两者研发路径均起始于发现阶段[3],化学家通过系统探索新分子,筛选具有目标生物活性的化合物。在植物保护研发中,这些目标领域主要包括杂草防控、害虫治理和病害抑制。
一旦在特定化学类别中发现具有潜力的生物活性信号,研究人员就需要建立构效关系以优化分子性能。该优化过程必须同步考虑多重参数,构成复杂的多因素优化挑战:候选分子不仅需要展现强大的生物功效,还必须满足人类、动物和水生生态系统的严格安全标准,同时具备环境相容性和适合商业化生产的物理化学特性。最终目标是开发出在适当配方下能够完全满足上市许可要求的活性成分。
将实验室验证的分子转化为商业化农业解决方案,还需要进行大量后续开发工作,包括在不同地理区域和农艺条件下开展全面田间试验,以确保产品性能的稳定性。
当前行业数据[4]显示,药品和植物保护产品的发现阶段平均耗时约4.5年。专利申请通常在发现阶段启动后2年内提交。在发现阶段之后,开发和注册阶段通常需要12-16年(药品)和9-12年(植物保护产品)。文献报道显示,植物保护产品的平均开发成本接近2.5亿美元,而新药的平均开发成本约为这一数字的6倍,达到15亿美元左右。
1.2 植物保护产品的专利时间轴
为确保对研发投入的充分保护,原研药企业通过系统化的专利布局为研发过程中产生的创新成果提供知识产权保护。覆盖具有生物活性的新化学类别的专利申请通常在研发早期阶段提交,即在分子合成和生物活性确认后立即进行。
这种早期专利申请策略由多个关键因素决定:首先是植物保护研究的竞争特性,竞争对手往往同时追踪相同或相似的化学类别[5]来发现新的活性成分;其次,“先申请”原则[6]固有的竞争机制激励了更早提交专利。另一个同等重要的考虑因素涉及研究发展途径。生物活性的初步识别通常在具有受控实验室或温室的限制性设施中进行,这些设施能够保证严格的机密性。但是在“内部设施”鉴定后不久,候选分子就需要进行外部田间试验,大幅增加技术披露风险。此发展过程增加了分子结构泄露的风险,可能通过形成现有技术而损害专利申请的可专利性。因此,在进行外部测试之前获得专利保护,是知识产权管理策略中维护独占商业化权利的关键。鉴于专利在提交专利申请之日起20年后到期,并且考虑到上述开发时间轴,专利所有者能够从市场独占期获得商业回报的时间明显受限(图1) 。
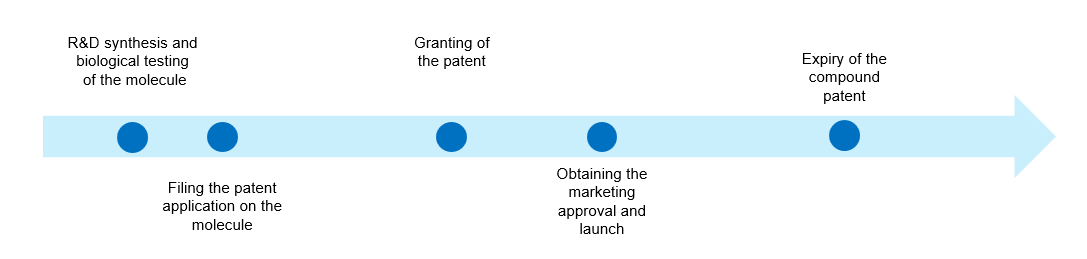
图1:专利时间轴示意图
1.3 仿制药公司的上市许可[7]
大多数国家已建立仿制药上市许可立法体系,允许仿制药企业参考原研药企业为获得原始上市许可所提交的研究数据。这种制度既适用于药品,也适用于植物保护产品。通过这种机制,仿制药企业避免了重复进行获得原始上市许可所需的试验和研究,显著降低了成本和时间投入。[8]
以美国为例,立法者旨在简化仿制药审批流程(从而向垄断性创新药市场引入竞争者,降低产品价格,保障公众获得平价药物的权益)。创新药企业必须进行繁重、冗长且昂贵的临床前和临床研究,以证明新药的安全有效性;而仿制药的要求通常仅限于证明仿制产品与参照产品的生物等效性。
具体而言,美国创新药制造商需向FDA提交新药申请(NDA),而仿制药制造商则提交简略新药申请(ANDA)。在ANDA中,仿制药制造商必须证明其在活性成分、规格、剂型和给药途径等多个参数上与参比产品[9]具有治疗等效性。"简略"一词体现了重要的监管便利——对于已经验证的成分和剂型,仿制药制造商通常无需重复进行资源密集型的临床前(动物)和临床(人类)研究。这种监管框架允许仿制药企业依托创新药企业在NDA审查过程中建立的安全有效性数据。
部分国家通过引入监管数据保护制度对原研药企业的数据提供专属保护。这种监管数据保护通常同时涵盖药品和植物保护产品[10]。监管数据保护独立于专利保护运作,且不一定能阻止仿制药在数据保护期内进入市场——仿制药企业仍可通过提交自身完整数据包而不参照原研数据的方式合法进入市场。如果这些企业选择将资源投入独立的临床开发,就可以规避数据保护规定。值得注意的是,与完全从头研究相比,重复研究的风险、时间和成本都较低,因为仿制药企业已经确信临床前和临床研究必然会成功(否则创新药企业的NDA就不会获得批准)。因此,对于认为早期市场进入比等待数据参考更有利可图的仿制药企业,不依赖原研药企业数据的选项是可行的。但这些情况也使数据保护的益处对原研药企业而言大打折扣。
Part.2
各司法管辖区期限补偿权(CTR)制度的研究比较
本节系统分析美国、欧盟、新加坡、日本和中国的CTR制度,通过比较研究提炼关键原则和结构要素,为中国向创新药市场转型提供制度设计参考。
2.1 美国的橙皮书制度
美国专利期限延长制度是其"橙皮书制度"的重要组成部分。"橙皮书"是一个简称,指涉及药品监管以及专利法方面的立法框架[11][12]。
2.1.1 制度概述
PTE有效延长了适用专利的保护期限,并非授予专利持有人的一项独立的权利。该制度适用于保护经FDA监管批准的产品或产品使用方法的专利[13],涵盖人用和兽用药品、食品添加剂、色素添加剂和医疗器械,但不包括植物保护产品[14]。
如上文所述,“橙皮书”是FDA“已批准的具有治疗等效性评价的药品”出版物的常用表述[15]。它包含根据联邦食品、药品和化妆品法案获得FDA监管批准的所有药品的详尽并具有权威的列表,以及与经批准的药品相关的专利和独占期信息。
橙皮书的意义超越了一般信息库功能,通过连接监管审批体系和专利保护制度,建立了药品专利链接体系。换句话说,橙皮书既影响药品专利保护体系,也影响药品所需遵守的监管审批制度。
原研药企业必须将其创新药品列入橙皮书以获得监管批准,同时需要披露与新产品相关的所有"相关"专利。
原研药企业必须提供每项专利的专利号和到期日期,这些专利可能会在未经许可的一方从事药品制造、使用或销售时被主张侵权,这些专利既包括药品专利也包括药品使用方法专利。
但某些专利不符合橙皮书登记资格,包括:根据1994年规定,保护已批准药品制造工艺的专利;根据2003年规定,保护代谢物或中间体、多晶型物的专利(除非NDA持有人有测试数据证明含多晶型物的药品与批准的药品表现相同),以及保护包装或容器的专利[16]。
仿制药企业需在橙皮书注册其仿制药。与原研药申请人不同,仿制药申请人在提交ANDA时必须针对原研药企业列出的专利提交四项"第I-IV段声明"之一。
这些声明实质上是仿制药企业对专利侵权状态的确认。第I段声明适用于橙皮书中批准的药物没有登记专利的情况;第II段声明声称所列专利已过期或无效;第III段声明承诺待专利到期后上市仿制药;第IV段声明则主张专利无效、不可执行或仿制药未侵权。
第I-III段声明不"主动挑战"专利有效性,满足条件后[17]FDA可继续进行ANDA审批。但第IV段声明不同——ANDA申请人通过主张专利无效、不可执行或未侵权,构成对原研专利的"主动挑战"。提交第IV段声明后,原研药企业有权直接起诉仿制药企业专利侵权,避免了在美国提起专利侵权诉讼通常所需的繁琐证据收集过程。
另一方面,成功提交第IV段声明允许仿制药申请人在专利到期前寻求上市批准。如果原研药企业提起侵权诉讼,则触发30个月停止期,期满后FDA可批准第IV段声明的仿制药申请人。此外,首家提交第IV段声明的仿制药企业可获得180天的市场独占期。
最后,橙皮书还包含PTE机制相关信息。根据PTE机制,原研药企业在专利申请后20年到期日之后可获得额外专利期限[18]。延长期限基于原研药企业进行所需临床前和临床试验耗时以及审批过程中的监管"延误"计算。
2.1.2 立法沿革
美国PTE立法是全球历史最悠久的CTR制度,也是公认的典范。美国作为首个建立专利期限延长机制的司法管辖区,通过1984年《药品价格竞争和专利期限恢复法案》(即Hatch-Waxman法案)引入PTE制度,补偿因临床试验和监管审批过程损失的时间。
2.1.3 申请程序
监管批准后60天内,原研药企业需提交PTE申请。申请材料包括:要求PTE的专利说明、批准产品说明和FDA许可日期、产品经过监管审查的声明、监管审查期说明、该许可是首次允许商业上市的声明,以及请求的延长期计算。申请提交至美国专利商标局,后者将申请转交FDA核实监管审查期,并在《联邦公报》公布。公布后开启180天公众咨询期,随后FDA计算官方监管审查期并将结果送交专利商标局,由专利商标局计算合格延长期并在符合条件时颁发延长证书。
2.1.4 期限计算与上限
PTE补偿FDA审批过程中的延误时间,最长可达5年,但不能使专利期限从获得上市批准之日起超过14年。保护范围限于含有/使用专利发明的产品的批准用途。
美国相关立法旨在补偿因监管机构"低效率"损失的时间,但不补偿因专利权人自身效率不足损失的时间。在美国,延长期限的计算较为复杂。[19]
2.2 欧洲[20]:补充保护证书(SPC)制度
2.2.1 制度概述
欧盟立法规定了补充保护证书而非专利期限延长。虽然SPC与PTE都是补偿药品和植物保护产品漫长监管审批过程时间损失的工具,但SPC不是简单的专利期限延长,而是一项单独的权利。
SPC在标准专利期限外提供最长5年的额外保护,以帮助维持有效的市场独占性并激励创新,这适用于因获得上市许可所需时间而导致专利产品商业开发延迟的情况。
SPC范围受专利权利要求范围约束,永远不能超出专利要求保护的范围。但在任何情况下,其限于批准的产品和(一种或多种)适应症,包括SPC到期前批准的产品任何新适应症。由于专利权利要求通常提供比批准产品和/或其适应症更广的保护范围,SPC为专利所有者提供的保护范围相对于专利保护而言较为有限。
2.2.2 立法沿革
1996年7月23日,欧盟通过关于植物保护产品SPC的第1610/96号条例(EC),该条例于1997年2月8日生效("96号条例"),系在针对药品领域的第1768/92号条例(EC)(下称"92号条例")于1993年1月2日正式实施数年后方予以确立。[21]
尽管药品和植物保护产品各有专门的SPC法规,但这两套法规在内容主旨和重要条款上几乎如出一辙。争论焦点是欧盟法院在药品SPC案件中的判决原则是否应该同样适用于植物保护产品。部分观点认为应当一视同仁地适用相关判例,而另一部分观点则反对这种做法,理由是两个行业存在本质差异和不同的市场运行规律。[22]
2.2.3 申请程序
为了获得SPC,专利持有者必须向每个寻求SPC保护的EU成员国提交SPC申请[23][24],各成员国根据国家专利局的实践单独审查和授予SPC。因此,欧盟成员国之间的结果可能存在显著差异,给SPC申请人带来相当程度的法律不确定性。为抵消国家专利局之间的差异,统一SPC将适用于统一专利,但拟议的法规也有其自身挑战。
SPC申请必须基于活性成分在欧洲经济区(EEA)内的首次上市许可[25]。它必须在活性成分在该国获得首次上市许可后六个月内提交,或者如果基础专利在该国获得首次上市许可后才被授权,则必须在专利授权后六个月内提交。
此外,欧洲大陆的其他国家也有国家SPC制度,例如阿尔巴尼亚、北马其顿、波斯尼亚和黑塞哥维那和塞尔维亚[26]。
尽管药品和植物保护产品的监管要求相似,但获得监管批准的程序有一些明显的差异。与受欧洲药品管理局(即一个单一的中央机构)管辖的药品不同,植物保护产品受到三个机构的审查。欧盟委员会基于欧洲食品安全局(EFSA)进行的风险评估,在EU层面管理活性物质的批准。欧洲经济区(EEA)成员国的国家主管部门负责处理成员国层面的产品批准、区域性审批及互认程序,从而使产品批准在整个欧盟境内具有效力。
植物保护产品的权力下放途径也在产品授权层面继续,即首次获得上市许可的成员国主管部门负责产品批准及其相应的区域性审批和互认程序。
2.2.4 期限计算与上限
补充专利证书期限的计算没有美国PTE期限的计算复杂。SPC的期限为专利申请[27]提交日至上市许可日之间的期限减去5年;但在任何情况下都不得超过5年。补充保护期从作为SPC基础的专利到期时开始。
虽然表面上看这种计算方法比美国法律规定的更简单,但问题往往在于细节。特别是由于欧盟内部缺乏统一做法,各国在确定何为'首次授权日期'时采用不同的方法和术语。是申请人收到申请成功通知的日期吗?是监管机构实际决定授予许可的日期吗?还是可能是完全不同的其他日期?[28]
2.3 日本专利期限延长制度
2.3.1 制度概述
在日本,与植物保护产品或药品相关的专利期限可以被延长至多5年,以补偿监管审批过程期间的时间损失。[29]尽管日本专利法将这些权利规定为专利期限的延长或PTE,但日本的补偿权制度与欧洲的SPC制度存在许多相似之处。凭借其独特特性和灵活性,该制度已被证明对原研药企业非常有利。特别是提交临时申请的可能性以及包括延长在内的总专利期限可达25年的规定值得关注。
2.3.2 立法沿革
1987年通过日本专利法修正案引入了植物保护产品的PTE条款。本制度自1988年1月1日起施行。引入这种期限补偿制度的关键因素包括:补偿监管延误、激励研究、与药品协调、国际接轨和经济考量。修正案引入了第67-67条之七。
2.3.3 申请程序
日本法律规定,“如果在一段时间内,某人由于需要获得许可而不能实施专利发明,而这是为了确保实施专利发明的安全或实现类似的目标”,则专利期限可以延长至多5年。
日本PTE制度强烈反映了其目标,即充当监管审批期间的时间损失的补偿机制。首先,原研药企业只有在收到关于产品(活性成分)和用途(适应症或效果)的监管批准后,才有资格向JPO提交专利期限延长申请。
原则上,申请必须涉及专利产品在产品和用途方面的首次监管批准。只有在以下情况下才可以依赖随后的监管批准:(1)涉及与先前监管批准不同的适应症,或者(2)针对与先前监管批准不同的活性成分(不包括不同的盐),并且专利的权利要求也涵盖“该不同的活性成分”。
当考虑到日本制度允许基于单个监管批准对多项专利进行PTE时,监管批准的重要性更加明显。例如,在单个监管批准涉及产品(化合物)专利、用途专利和方法专利的情况下,每项专利都可以基于同一监管批准而被延长,只要这些专利涵盖了监管机构批准的活性成分。此外,决定PTE保护范围的是监管批准中定义的产品,而不是专利权利要求。
提交授予PTE的申请的截止日期与监管机构的批准相关联。原研药企业必须在收到批准的3个月内提交申请。如果监管批准预计要到原始专利期限到期前六个月的前一天才会批准,则PTE申请人必须提交临时申请,以相应地通知JPO。然而,这样的临时申请并不延长到期期限。
2.3.4 期限计算与上限
专利期限可以被延长最多5年。鉴于其对原研药企业的友好性,在日本制度中,期限延长的计算相当简单:授予的延长期限等于被授权的机构开始田间试验阶段[30]之日或专利被授权之日(以较晚者为准)到监管批件邮寄给监管批准申请人的前一天之间的时间段。
鉴于多个监管批准可能与单项专利相关,所述单项专利也可以被授予多个PTE。然而,在这样的情况下,每个PTE补偿各自的批准过程期间的时间损失。换言之,如果专利X的适应症A的批准过程耗时3年,则PTE期限为3年,如果专利X的适应症B的批准耗时4.5年,则依赖于适应症B的批准而授予的专利X的原始期限的延长也将是4.5年。
总体而言,与大多数其他司法管辖区一样,总专利期限(原始专利期限加上专利期限延长)不能从申请日起超过25年,无论就单项专利授予了多少个PTE。
2.4 新加坡PTE制度
2.4.1 制度概述
新加坡法律为所有专利提供PTE,前提是在专利授权过程期间出现不合理的延误。为了支持不断增长的生物医学科学行业,新加坡法律还引入了专门适用于药品的PTE,以补偿原研药企业在监管审批过程期间的时间损失,该过程具有很高的资格门槛。法律没有为植物保护产品提供PTE,尽管它们也必须经历漫长的监管审批过程。
尽管如此,但药品的PTE已经产生了明显的战略影响,主要在于保护新加坡作为财政收入源泉。新加坡2023年制造业总产值为3925亿美元[31],2024年非石油国内出口(包括电子产品、石化产品和药品)为1740亿美元[32],是全球市场上的重要制造基地。
时至今日,监管审批流程仍然漫长:完整的新药申请(“NDA”),即从未获得任何药品监管机构批准的任何新产品的NDA在提交后需要超过410天才能获得批准。简略NDA是指已经获得至少一个(其他/外国)药品监管机构批准的产品的药物申请。从申请提交之日起,它们的审批时间超过280天。有趣的是,简略仿制药申请("GDA")需要超过370天,比简略NDA平均更长90天。监管治疗产品的新加坡卫生科学局(HSA)表示,这些时间表反映了它们的申请量和资源分配优先级,确保对所有仿制药申请保持全面的评估标准。与NDA相比,简略GDA的较长时间可能是由于GDA的额外生物等效性要求(如制造标准、处方等)。后者利用已经批准该产品的外国监管机构的现有临床数据,从而减少评估负担和时间。
2.4.2 立法沿革
依据美国-新加坡自由贸易协定,新加坡于2004年将PTE纳入其立法体系。该制度与其他司法管辖区的PTE机制功能相似,均旨在为专利持有人因监管当局审批程序导致的、超出其控制范围的专利期限损耗提供补偿。
引入PTE制度也是生物医学科学发展的若干组成部分的一部分,在新加坡自1991年开始实施的一个五年计划中,生物医学科学被确定为具有巨大的增长潜力。2005年科学和技术计划见证了国家科学和技术委员会(NSTB)重组为科技研究局(“A*Star”)[33],并启动了新加坡生物医学科学倡议。这一系列变化清楚地表明,新加坡正在多个层面推动生物医药产业的发展。
2.4.3 申请程序
在新加坡,专利期限延长为专利权人提供了额外时间,使其能够在标准20年专利保护期之外继续销售其专利发明。如前所述,新加坡法律对申请人设定了严格的条件要求,这可能构成一定负担。此外需要特别说明的是,即便满足了相关条件,PTE申请也仅仅是具备了申请资格,而非自动获得延期权利。
新加坡可以获得PTE的依据包括:(1)专利局在授予专利过程中出现不合理延迟,或(2)在取得药品上市许可过程中导致专利实施机会的不合理缩减[34]。在申请过程中,原研药企必须证明存在上述情形。
当专利申请提交与专利授权之间的时间间隔超过4年时(不计入因申请人行为或不行为造成的任何时间,比如申请人回复专利局要求所耗费的时间,即使是按时提交),新加坡专利注册官在专利授权方面的延迟可被认定为不合理。举例而言,在审查程序中,申请人可在收到审查意见后5个月内进行答复。即使此类答复在截止期限内按时提交,该时间段仍被视为归因于申请人,因此不计入4年期限范围内。
如果药品的上市许可是在专利授权后获得,且上市许可申请与批准日期之间的间隔超过2年(不计入因申请人行为或不行为造成的任何时间),则被认定为药品上市许可程序导致专利实施机会的"不合理缩减"。与专利授权程序中的延迟情况类似,申请人回复新加坡卫生科学局(HSA)询问所耗费的任何时间都可被视为归因于申请人,并排除在2年门槛之外。[35]
基于药品上市许可延迟的PTE申请必须在获得新加坡上市许可或专利授权(以较晚发生者为准)后6个月内提出,且不得晚于20年专利保护期届满前6个月,同时专利必须仍处于有效状态。
2.4.4 PTE期限计算与上线
如前所述,新加坡PTE旨在补偿专利权人因超出其控制范围的因素而遭受的时间损失。尽管因专利授权程序不合理延迟而获得的PTE原则上不设上限,但因药品监管审批程序不合理缩短而可获得的期限延长最多限于5年。
因商业化实施药物专利机会不合理缩减而授予的延期期限,仅相当于以下三项中的最短者:(1)专利授权批准日期与上市许可批准日期之间的时间间隔;(2)上市许可申请与批准日期之间超出2年部分的时间间隔(不包括任何可归因于申请人的时间);或(3)5年期限。
2.5 中国PTE与专利链接制度
2.5.1 制度概述
中国专利期限延长及专利链接制度深受美国专利期限延长及“橙皮书”制度的启发。像在美国那样,创新者需要登记相关专利[36]。对于创新者而言,这一制度允许早期有效预防侵权。引入专利链接制度的理由之一在于允许专利权人和潜在侵权的仿制药企业之间的争议在仿制药上市申请审批阶段就得到解决,而不仅仅是在上市后。它给仿制药公司带来了在生产和准备销售之前创造明确性的益处。另一方面,它减轻了专利权人的诉讼负累。仿制药企业必须披露关于药物的技术信息。这转移了举证责任,节省了时间和资源。相关专利期限延长也类似于在美国获得的期限。
尽管PTE的概念在中国和美国非常相似,但是中国的实施在若干重要方面与美国不同。例如,获得PTE的条件和保护范围明显不同。在中国,药物必须是“全球新”,新适应症的批准才能符合PTE的条件。然而,PTE的范围限于已批准的药物及其作为延长基础的已批准适应症,并且不会扩展到先前批准或将来批准的适应症。相比之下,在美国,PTE是基于药物的首次批准或上市许可而授予的,无论它是否是“全球新”。
中国的PTE与专利链接制度在药品适格性标准上存在差异,尤其是在新颖性要求方面。对于PTE,药品在提交新药申请(NDA)时必须是“全球新的”,即在NDA提交日期之前,该药品未在任何其他国家获得上市批准。然而,它无需是全球首次提交或首次获批的药品。相比之下,专利链接制度没有新颖性要求。任何在中国获批上市的原研药均适合,无论其是否为全球新、是否为全球首次提交或首次获批。因此,在药品适合性方面,专利链接制度比PTE限制更少。
2.5.2 立法沿革
随着2020年中国专利法的修订,专利链接制度被引入中国法律[37]。专利链接是将药品审批过程与专利纠纷解决相衔接的药品专利纠纷早期解决机制,旨在在仿制药上市许可申请审批阶段部分地解决潜在侵权纠纷。该制度被设计为在9个月内以降低的成本解决专利链接纠纷。首个挑战专利成功并首个获批上市的化学仿制药可获得12个月的市场独占期,这显然是对挑战专利的激励。
Part.3
全球举措
3.1 巴西:需要植物保护产品专利期限延长的国家?
巴西是全球植物保护产品消费量最大的市场之一,也是该类产品的主要进口国之一。此外,巴西本土市场的农业挑战需要持续的植物保护创新。
在巴西境内销售农产品的监管批准涉及的不同的程序。以下产品可能需要在巴西获得监管批准,例如:(i)种子和幼苗,受第10,711/2003号法律管辖;(ii)转基因生物,受第11,105/2005号法律管辖;(iii)生物制剂,受第15,070/2024号法律管辖;和(iv)环境控制产品和农用化学品,受第14,785/2023号法律监管。
所有这些产品都需要申请人付出巨大努力才能获得上市批准,申请人必须进行广泛的研究和测试以满足这些监管标准,通常需要数年时间并需要大量的财务资源。
除此以外,巴西在获得上市批准的监管审批过程中面临大量积压。为了解决积压,巴西成文法引入了巴西当局必须完成监管审批过程的最后期限[38]。尽管做出了立法努力,但这些时限在实践中很少得到遵守。
在植物保护产品的情况下,重大延误的主要原因在于监管审批过程复杂,需要3家不同监管机构并行分析,即ANVISA(巴西食品和药物管理局,分析与人类健康相关的方面);MAPA(农业和畜牧业部,负责分析农艺有效性和实用性)和IBAMA(巴西环境保护实体,分析产品对环境的安全性),在MAPA最终颁发各自的注册证书之前,它们中的每一个都必须批准申请[39]。总体而言,当局平均需要6、7年[40]才能完成对新植物保护产品原药和制剂的注册请求的分析。
不幸的是,巴西在专利审查过程中也面临大量积压。考虑到这一点,巴西于1996年引入了一项法定条款,允许专利在授予后10年内保持可实施性(巴西专利法(BPS)第40条的唯一一款)。鉴于审查过程的积压,该条款规定的专利期限远远超过授予后的“正常”20年。然而在2021年,巴西最高法院裁定该条款违宪[41]。通过这样做,它恢复了标准的20年专利期限,从申请日开始计算。现在,专利持有者面临着收回研发投资的双重问题。监管机构需要很长时间批准产品上市,专利只有在长时间审查后才能被授予。
为了补偿时间损失和激励巴西的研发,似乎有必要在巴西法律框架中引入PTE。
3.2 中国:“一视同仁”[42]
中国是消费量最大的植物保护市场之一,也是该行业最大的制造基地。中国也是近年来成立许多新研发公司的国家,例证在于,过去5年中绝大多数拟议的ISO通用名称都是由中国研发公司提出的化合物。[43]
中国立法机构已认可了药品专利期限延长制度的价值。然而,尽管药品与植物保护产品的开发时间明显相似,但后者却未被纳入可适用专利期限延长的产品范围。
Part.4
结论
创新对农业而言至关重要。将新型植物保护产品推向市场是一项昂贵、漫长且风险巨大的努力。专利可以为投资回报提供一定的保证,也可以减轻一些风险。然而,由于增加的监管要求以及随之而来的从事研究和评价新植物保护产品的时间和成本增加,原研药企业/专利权人面临着这样的风险:他们能够从市场独占地位受益的时间变得过短而无法收回其投资成分。
国际上普遍认可一项原则:延长专利保护期限是补偿原研药企业损失专利期限的一种切实可行的机制。事实上,若干国家,特别是意欲刺激本土(国家或区域)研究和开发的国家,已经引入并且维持了他们的期限补偿权制度。
中国已经引入了药品专利链接制度和专利期限补偿机制,因此证实了相关期限补偿权机制是中国立法可以接受的制度。
考虑到农业对全球(特别是对中国)的重要性,考虑到中国政府激励研发(尤其是农业领域研发)的战略目标,更考虑到中国目前已形成相当规模的原研药企业群体,这些企业都将从专利期限延长制度中受益,现在正是探讨将植物保护产品纳入专利延期制度的恰当时机。
注释:
[1]我们将“期限补偿权”定义为涵盖专利期限延长和补充保护证书二者的上位术语。
[2]研讨会和文章的目的都不在于对在中国的植物保护产品的期限补偿权提出具体建议。目的在于收集关于现有制度的信息,然后这些信息可充当进一步讨论和建议的基础。
[3]在药学术语中,相对于可以是抗体、蛋白质等的“大分子”,这是指“小分子”研究。尽管“植物保护生物制品”作为潜在的植物保护产品现在非常受关注,但大多数重要的植物保护产品都是小分子。
[4]Phillips McDougal R&D Study 2016.
[5]鉴于商品成本的限制,植物保护产品化学品空间小于药品空间。换句话说,植物保护产品公司可选择的化学结构"池塘"较小,这迫使公司不得不寻找结构非常相似的化合物。
[6]目前所有国家都已采用先申请制度。美国是唯一的例外,它实行的是"第一发明人先申请"原则。
[7]虽然本文不专门讨论监管数据保护或数据独占期,但仍需简要说明,因为某些CTR制度与监管流程相互关联,并涉及监管数据保护。
[8]在美国,原研药企业提交"新药申请"(NDA)。当仿制药公司希望利用原研药企业已提交的信息时,仿制药公司需提交"简略新药申请"。
[9]参比产品是指原研药企业在提交NDA后获得上市批准的药品。
[10]在美国,FIFRA规定植物保护产品原研药企业自初次注册起10年内独占使用监管数据。此外,此后存在5年的“可予补偿期”。在“可予补偿期”内,仿制药公司可以获得监管数据。然而,仿制药公司需要向数据所有者支付补偿。
[11]需要注意的是,植物保护产品不符合美国专利期限延长的条件。
[12]我们可以参考现有的立法草案。
[13]食品和药品管理局是卫生与公众服务部的一部分。它通过监管人用和兽用药物、疫苗和其他生物制品、医疗器械、美国食品供应、化妆品、膳食补充剂、电子辐射发射产品和烟草产品来保护公众健康。
[14]植物保护产品与药品同等地受到监管。《联邦杀虫剂、杀真菌剂和杀鼠剂法案》(FIFRA)授权环境保护局(EPA)监管美国农药和农药设备的分销、销售、生产和使用。
[15]可经由下述在线访问:https://www.fda.gov/drugs/drug-approvals-and-databases/approved-drug-products-therapeutic-equivalence-evaluations-orange-book。
[16]不当登记可能被视为反竞争,违反美国反垄断法规,从而可能引发反垄断法制裁。在这方面,必须指出的是,联邦药品管理局(“FDA”)作为审批机构的职能纯粹是政务性质的。FDA不决定登记的适当性。因此,关于提交专利信息的《联邦法规》(“C.F.R.”)第21条314.53(f)(1)允许任何相关方请求更正橙皮书中公布的专利信息。2023年,联邦贸易委员会(“FTC”)发布了一份关于原研药制造商及其在橙皮书中不当登记专利的声明。FTC向原研药公司发出了相应的信函,目的在于提醒它们有责任确保正确登记它们的专利。迄今为止,只有三家公司在收到FTC的此类信函后终止登记,FTC的努力收效甚微。
[17]例如,在第III段中,仿制药公司同意等到专利不再有效。
[18]值得注意的是,美国不仅规定了授予药品原研药企业的专利期限延长。美国还规定了专利期限调整(PTA)制度,这是任何专利持有者在美国专利商标局对专利的审查出现延误时可以获得的延期。专利期限延长与专利期限调整累积。
[19]1982年,35 U.S.C.155就已经提出了为农用化学品引入PTE的立法。不幸的是,它从未付诸表决,因此仍在等待投入使用。
[20]这项立法适用于欧洲联盟,但也延伸至欧洲经济区的国家。自英国退出欧盟以来,英国不再是欧盟成员。尽管如此,英国仍然维持SPC立法。
[21]虽然第96号条例是迄今为止管理植物保护产品的SPC的相关立法法案,但关于药品SPC的第92号条例已于2009年被条例(EC) 469/2002号取代。我想提及有关药品的第92号条例(其后修订)及有关植物保护产品的第96号条例。
[22]欲了解更多信息,请参考V-Cumaran Arnuaslam和Filip de Corte的《植物保护产品的补充保护证书:‘丑小鸭’的故事(Supplementary protection certificates for plant protection products: the story of 'The Ugly Ducklin')》,发表于《知识产权法律与实践杂志(Journal of Intellectual Property Law & Practice)》,2016年,第11卷,第11期,第833页及之后。
[23]SPC可以在欧洲经济区(EEA)获得,即在欧盟所有成员国加上挪威、冰岛和列支敦士登。
[24]英国和瑞士拥有各自对映但并不完全相同的制度。
[25]EEA包括欧盟、冰岛、列支敦士登和挪威。当英国在2020年1月31日离开欧盟时,它也离开了EEA。请注意,瑞士既不是欧盟成员,也不是EEA成员。
[26]请注意,拥有SPC立法是“既成协定(acquis communautaire)”的一部分,换言之,一个国家在成为欧盟的一部分时需要通过这样的立法。
[27]国家专利、欧洲专利或单一欧洲专利。
[28]欧盟各国做法不一致给某项制度带来的复杂性,在单一国家适用该制度(如SPC)时并不会产生影响。
[29]本文关注于根据《日本专利法》第67(4)条授予的PTE。它们不能与根据《日本专利法》第67 (2)条授予的“期限缩短”的延期相混淆。由于后者与美国专利术语“调整”在概念上的相似性,它们有时被称为PTA而不是PTE。与第67(4)条中定义的PTE不同,PTE补偿了监管审批过程中的时间损失,第67(2)条中定义的延期补偿了专利审批过程中的缩短。
[30]对于农用化学品,监管审查过程有两个阶段:(1)田间试验阶段和(2)审批阶段。
[31]新加坡统计局。
[32]2024年新加坡经济调查。
[33]科技研究局(“A*Star”)隶属于新加坡贸易和工业部。它旨在支持与新加坡竞争优势和国家需求领域相一致的研发。
[34]1994年专利法第36A (1)条。
[35]有资格延长专利期限必须满足的条件包括监管机构提供上市批准的延误造成的时间损失,以及专利局在授予专利期间造成的延误。换言之:在两个系统中的一个系统中损失的不合理时间可以提供PTE的资格。
[36]目前的法规阻止了晶型专利和生物组合物专利的登记。然而,考虑到这些专利对药物疗效的重要作用以及仿制药侵权的高风险性,理应将其纳入可登记专利的范畴。
[37]《中华人民共和国专利法》第七十六条。
[38]对于种子和幼苗,自提交强制性信息和文件之日起30天(第10,711/2003号法律;对于生物制品,12个月(第14,785/2023号法律,将由关于第15,070/2024号新法律的待决条例取代);对于新配制或技术产品,24个月;对于配制或仿制产品或等同技术产品,12个月(第14,785/2023号法律);对于转基因生物,自提交强制性信息和文件之日起120天(第11,105/2005号法律);对于环境控制产品,自提交强制性信息和文件起12个月(第14,785/2023号法律)。
[39]有关队列的更多信息,可访问https://www.gov.br/agricultura/pt-br/assuntos/insumos-agropecuarios/insumos-agricolas/agrotoxicos/filas-de-registro-de-agrotóxicos。
[40]https://sindiveg.org.br/registro-de-agroquimicos-no-brasil/.
[41]宪法挑战(ADI)#5,529,由联邦最高法院裁决。
[42]英文谚语"What is good for the goose is good for the gander"(直译为"对雌鹅有益的对雄鹅也有益"),意指公平公正、一视同仁的原则。
[43]研发企业在开发新活性成分档案的过程中,会在适当时机申请ISO通用名称的审批。因此,这一申请可作为特定时期内化合物研发进展的重要标志。
(原标题:全球主要司法管辖区植物保护产品的期限补偿权[1]<CTR>)
栏目支持,共建合作伙伴持续招募
来源:IPRdaily中文网(iprdaily.cn)
作者:Antonia Schmidt, Toni-Junell Herbert, Eduardo Hallak, Achim Krebs, Ian Goh, Chris Shaowei, Filip De Corte
通讯作者:Dr. Sc. Filip De Corte, Head IP Syngenta Crop Protection
编辑:IPRdaily辛夷 校对:IPRdaily纵横君
注:原文链接:全球主要司法管辖区植物保护产品的期限补偿权(CTR)(点击标题查看原文)

「关于IPRdaily」
IPRdaily是全球领先的知识产权综合信息服务提供商,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn”

 共发表文章
1002篇
共发表文章
1002篇- 我也说两句
- 还可以输入140个字